ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- 胎児の神経を形作る仕組みは精密な温度センサー ―母体の体温維持が神経の成熟に重要であることを示唆―
プレスリリース
2021.11.10
胎児の神経を形作る仕組みは精密な温度センサー ―母体の体温維持が神経の成熟に重要であることを示唆―
- 【研究成果のポイント】
- ・精製したタンパク質は熱に弱く、機能を失いやすいため、体温付近での性質を調べるのが一般に困難
- ・赤外レーザーによる精密加熱技術を用いて体温付近での実験に成功したことで、神経細胞が力を出し、形を変えるときに働くタンパク質に、温度センシング能力があることを発見
- ・母体の体温が37℃で厳密に維持されていることが、胎児の神経の成熟に重要であることを示唆
概 要
大阪大学蛋白質研究所蛋白質ナノ科学研究室の鈴木団講師と、東京都健康安全研究センターの久保田寛顕主任研究員、京都大学白眉センターの宮﨑牧人特定准教授(兼JSTさきがけ)、早稲田大学の小川裕之氏(研究当時)、および石渡信一名誉教授らによる共同研究グループは、神経細胞の成熟に重要な細胞内の仕組みが、温度によって精密に制御されることを発見しました。
私たちの体に備わる温度センサー※1が今年のノーベル医学・生理学賞の対象になったのは、まだ記憶に新しいでしょう。温度センサーが、細胞のある特定の要素(タンパク質)であるのを見出したことが、受賞理由の一つでした。しかし、体の中で起きている化学反応(例えば食べ物の消化や代謝)や物理的な過程(例えば神経伝達物質の拡散)は一般に、温度に応じて変化します。温度変化がわずかなら、それぞれの反応もあまり大きくは変わりません。しかし「生命」は、それらの複雑な反応ネットワークです。温度が少し変化しただけで、ネットワーク全体の挙動が大規模に変化するといった可能性は、無いのでしょうか?
このようなアイディアの検証を続けて来た鈴木講師らのグループは、今回、動物の胎児の神経細胞に存在し、細胞の中で力を出して細胞の形づくりに関わるタンパク質と、温度に応じた力の制御に着目しました。そして精製した3種類のタンパク質を用いて、細胞内の現象を人工的な環境下で再構成しました。一般にタンパク質は、精製すると熱に弱くなります。しかし研究グループは、赤外レーザーを用いた素早く精密な温度操作技術を顕微鏡による計測技術と組み合わせることで、体温付近での実験に成功しました。その結果、37℃付近でのみ、力の制御が鋭敏になることを発見しました。母体の体温の精密な制御には、タンパク質が出す力を整え、神経系の正常な成熟を支える役割があることが示唆されます。また細胞に備わる様々な温度センサーの理解が進めば、ナノスケールの温度センサーを、人工的に作れるようになるかもしれません。
本研究成果は、アメリカ化学会(ACS)発行の「Nano Letters」(オンライン)に、11月9日(火)22時(日本時間)に公開されました。
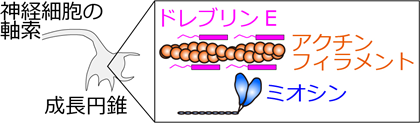
図1.ミオシンとアクチンフィラメント(タンパク質のフィラメント)は相互作用して力を出し、細胞の形が決まる。神経細胞の成長円錐に局在するタンパク質ドレブリンEは、このアクチン・ミオシン相互作用を抑制する働きを持つ。動物の胎児が成長する初期に、神経細胞の成熟に伴いドレブリンEの濃度が減少する。しかし、特に体温付近で、濃度の変化がアクチン・ミオシン相互作用をどのように変えるのか、不明だった。
研究の背景
私たちヒトを含む哺乳類の胎児は、母親の胎内で成長します。このとき、神経細胞の突起が長く伸びて(「軸索」)、別の神経細胞とつながります。軸索が伸びる仕組みはその先端(「成長円錐※2」)にあり、力を出して細胞の形を変えたり、力のOn/Offを調節したりする要素が集まっています。力を出すタンパク質の代表例がミオシンとアクチンフィラメント※3で、成長円錐での調節役の一つが、ドレブリンE※4と呼ばれるタンパク質です(図1)。
これまでに、ドレブリンEの濃度は、神経細胞の成熟に伴い減少することが知られていました。しかし、ドレブリンEの濃度変化が力をどのように変えるのか、詳細は不明でした。一般には、標的とするタンパク質を精製し、計測すれば、機能を詳しく調べることができます。ところが、特にミオシンが熱で失活しやすいために、生理的温度である37℃付近での実験が、非常に困難でした。
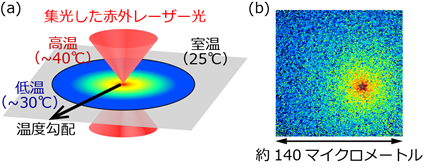
図2.(a)局所熱パルス法の模式図。(b)局所熱パルス法により形成された温度勾配を、蛍光色素を用いて可視化することで、顕微鏡の視野内において、どこが何℃であるかがわかる。中央やや右下が熱源の中心(薄い色の星型)で約40℃、視野の端が約30℃の温度勾配を示す。このとき視野は縦横約140マイクロメートル(髪の毛の太さの1.5倍程度)。
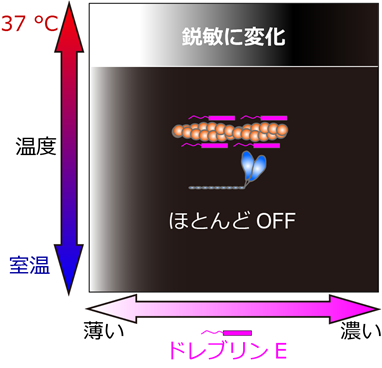
図3.精密な温度制御技術を用いた実験から、ドレブリンEは、体温付近でのみ力のOn/Offを鋭敏に制御できることが分かった。白―黒のグラデーションは、白は力を出せる状態(On)、黒は出せない状態(Off)。
研究の内容
そこで研究グループは、アクチン、ミオシン、ドレブリンEの3つの精製タンパク質を利用した実験系に、局所熱パルス法※5を組み合わせました(図2)。局所熱パルス法には、①顕微鏡の視野内に形成される局所的な温度勾配を利用して、タンパク質の活性を様々な温度でいっぺんに計測できること、②レーザー光の照射時間をシャッターで調節することにより、タンパク質が熱でダメージを受けるよりも早く温度勾配を消せるため、通常では実験が難しい、高温でのタンパク質活性を計測できること、の2つの特徴があります。これらの特徴によって、上述の技術的課題を解決し、実験に成功しました。ミオシンとアクチンフィラメントの相互作用の解析は、直径が10 nm(髪の毛の太さの一万分の一程度)に満たないアクチンフィラメントを蛍光色素で明るく光らせることで可視化し、相互作用によりアクチンフィラメントが動く様子を、画像解析から正確に追跡することで行いました。
顕微鏡で観察したところ、視野内の温度が室温の時は、これまでの報告通り、ドレブリンEがミオシンとアクチンフィラメントの相互作用を阻害するという結果でした。ところが熱パルスを与えた途端に、ドレブリンEを結合したアクチンフィラメントが動き出すという、予想外の現象が見つかりました。そこで温度とドレブリンEの濃度を様々に変えて実験を繰り返しました(図3)。すると37℃付近でのみ、しかもちょうどドレブリンEが生体内の濃度の範囲にあるとき、濃度が少し変われば力のOn/Offが鋭敏に変化する、すなわちOn/Offを効果的に切り替えられる特徴があることがわかりました。しかし、たった1℃低いだけでも、濃度を大きく変えても力のOn/Offが上手く切り替わりません。
本研究成果が社会に与える影響(本研究成果の意義)
ドレブリンEの濃度変化による力の制御、という生理機能は、生理的温度でのみ効果的に出現することがわかりました。これは、細胞の中で起きている反応が37℃で正しく機能するように整っていることを示す、一つの例であると言えます。たとえ環境の温度が変化しても、母体の体温が37℃で厳密に維持されていることが、胎児の神経の正常な成熟にとって重要であることを示唆しています。
今年のノーベル医学・生理学賞の対象は、私たちの体に備わる温度センサーが、特定のタンパク質であることの発見でした。一方、本研究グループが見出した、温度により応答を大きく変えるアクチン、ミオシン、ドレブリンE、の3つのタンパク質の組み合わせは、タンパク質複合体型の温度センサーだと言えるでしょう。個々のタンパク質では温度と機能の関係が比較的よく研究されていても、他のタンパク質との相互作用まで含めた関係は、あまりわかっていません。細胞の中には、きっと複合体型の温度センサーが、思いもよらない形で隠れているだろうと、研究グループは考えています。細胞に備わる温度センサーについて詳しく知ることで、将来、ナノスケールの温度センサーを人工的に設計して作る、といったことも可能になるかもしれません。
特記事項
本研究成果は、2021年11月9日(火)22時(日本時間)にアメリカ化学会(ACS)発行の「Nano Letters」(オンライン)に掲載されました。
タイトル:“Microscopic temperature control reveals cooperative regulation of actin–myosin interaction by drebrin E”
著者名:Hiroaki Kubota†, Hiroyuki Ogawa†, Makito Miyazaki†, Shuya Ishii, Kotaro Oyama, Yuki Kawamura, Shin’ichi Ishiwata*, and Madoka Suzuki*
†共筆頭著者、*共責任著者
DOI:https://doi.org/10.1021/acs.nanolett.1c02955
なお、本研究は、日本学術振興会科学研究費補助金、JSTさきがけ(JPMJPR20ED)、公益財団法人発酵研究所、ヒューマン・フロンティア・サイエンス・プログラム(HFSP)の支援により得られたものです。
用語説明
※1 温度センサー
日常的に目にする「温度計」は、部屋や体といった対象の温度を、比較的広い温度範囲で教えてくれる道具である。一方、ここで言う「温度センサー」とは、ある温度を中心に、狭い温度範囲で応答が大きく変わるもののことを指し、一般的な温度計とは区別して用いている。応答の温度範囲が少しずつ異なる温度センサーが、複数種類、同時に備われば、低温から高温まで感知できる。私たちに備わる仕組みも同様である。ある特定の種類のタンパク質が、それぞれの温度範囲を担当する温度センサーとして知られ、詳しく研究されている(最初の発見が2021年ノーベル医学・生理学賞)。
※2 成長円錐
神経細胞が成長するときに伸びてゆく突起のうち、特にその先端を指す言葉。神経細胞の中で、形が大きく変わる部分であり、形を変えるために細胞が出す力の制御や方向を決める仕組みについて、わからないことが多い。
※3 ミオシンとアクチンフィラメント
多くの細胞において、力を出すタンパク質の代表例。特に筋肉に豊富に存在しており、手足の動きはこれら二種類のタンパク質の働きによる。ミオシンはアデノシン三リン酸(ATP)を加水分解する能力を備え、化学エネルギーを力学的エネルギーに変換する。アクチンフィラメントは、タンパク質のアクチン分子がフィラメント状につながったもの。この二つが相互作用することで力が出る。図1も参照。
※4 ドレブリンE
アクチンフィラメントに結合するタンパク質で、ミオシンとアクチンフィラメントが出す力を制御することが知られているが、その仕組みの多くは不明。図1も参照。
※5 局所熱パルス法
顕微鏡技術と組み合わせて、視野内の温度変化を精密に制御する方法。水に良く吸収される波長の光をレンズで集光し、水中に、局所的な温度勾配を瞬時に形成する。図2も参照。
鈴木講師のコメント
大きなヒトの体温を測ったり温めたりするのは、簡単です。でも、非常に小さな細胞やタンパク質では、温度を測ったり熱を操作したりすることが、極端に難しくなります。最近やっと、開発した新しい技術を用いて、細胞やタンパク質の大きさでも温度や熱の役割を実験的に検証できるようになってきました。まだまだ面白いことが見つかるだろうと期待して、研究を進めています。
参考URL
- 鈴木 団 講師 研究者総覧URL
https://rd.iai.osaka-u.ac.jp/ja/ca5ca6ff0ffeeff2.html
- 2021年1月16日ResOU “生きる”とは?私たち生物の細胞が熱を伝えるメカニズムの解明へ。
http://www.protein.osaka-u.ac.jp/achievements/press_release20210112/


