ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- 悪性高熱症を単一細胞レベルで再現することに世界で初めて成功! ~吸入麻酔薬や筋弛緩薬投与後の体温上昇メカニズム解明へ期待~
プレスリリース
2022.10.07
悪性高熱症を単一細胞レベルで再現することに世界で初めて成功! ~吸入麻酔薬や筋弛緩薬投与後の体温上昇メカニズム解明へ期待~
概要
東京慈恵会医科大学基盤研究施設の医学科 坪井義高、山澤德志子 准教授、細胞生理学講座の福田紀男 准教授と大阪大学蛋白質研究所の鈴木団 講師らを中心とする共同研究グループは、全身麻酔時に高体温になる悪性高熱症[※1]のモデルマウス(MHモデルマウス)の骨格筋細胞を詳細に解析し、悪性高熱症を単一細胞レベルで再現することに世界で初めて成功しました。
研究グループは、MHモデルマウスの骨格筋細胞のカルシウムイオン(Ca2+)動態と横紋構造の異常(サルコメアの長さの短縮)を明らかにし、吸入麻酔薬の投与によってMHモデルマウスの骨格筋の温度が上昇することを単一細胞レベルで可視化することに成功しました。
本研究は、吸入麻酔薬や筋弛緩剤投与後に起こりうる悪性高熱症の分子レベルでのメカニズム解明に重要な知見を与えるとともに、悪性高熱症の予防戦略や治療薬の開発を強力に促すことが期待されます。本研究成果は、米国の生理学雑誌「Journal of General Physiology」のオンライン版(2022年10月6日:米国時間)に公開されました。
研究の背景
骨格筋は、細胞内のCa2+貯蔵庫である筋小胞体から骨格筋型リアノジン受容体(RyR1)[※3]を介してCa2+が放出され、Ca2+が収縮タンパクに結合することで収縮します。RyR1に遺伝的な変異があるとCa2+が筋小胞体から過剰に放出されます。悪性高熱症の患者さんでは、RYR1遺伝子に異常が見られることが知られていました。
我々の研究グループは、イソフルラン[※4]麻酔を投与することで体温が上昇して死亡してしまう新規のMHモデルマウスを作製しました(引用文献1)。この変異マウスは、ホモ接合体[※2]では、胎児の間に子宮内で死亡してしまいました。そのため、ホモ接合体細胞(ホモ細胞)のCa2+の動態については検証することができませんでした。また、我々は最近の研究において、遺伝的な変異のあるRyR1を発現している細胞では熱刺激に敏感に応答して細胞内Ca2+濃度の上昇が引き起こされることを発見し、この現象を「熱誘発性カルシウム放出」と名付けました(図1, 引用文献2)。しかしながら技術的な困難さのため、これまでの研究では、イソフルラン投与による動物の体温上昇と骨格筋における細胞内Ca2+濃度の上昇は別々の実験でしか確認することができず、これらの間の連動性を細胞レベルで捉えることはできませんでした。
本研究では、今まで研究が進んでいなかったMHモデルマウスのホモ細胞の解析を詳細に行うとともに、細胞内Ca2+濃度の変化と細胞内温度の変化を同時に可視化することを試みました。
研究の内容
・ホモおよびヘテロ細胞の解析
本研究では、新規MHモデルマウスについて、胎児マウスの骨格筋細胞を用いて実験を行いました。まず、ホモ細胞を電子顕微鏡で観察すると、サルコメア[※5]が野生型に比べて大幅に短くなっていました(図2)。次に、ホモ接合体と野生型の細胞内Ca2+濃度を測定したところ、ホモ接合体では野生型に比べて細胞内Ca2+濃度が高くなっていました。これらの結果から、死亡してしまうホモ接合体胎児マウスでは、細胞内のCa2+濃度が上昇することで骨格筋が過剰に収縮していることが強く示唆されました。
さらに、骨格筋細胞に赤外線レーザーを照射し、熱刺激に対する細胞内Ca2+濃度の変化を観測しました。熱刺激時、ヘテロ接合体[※2]細胞(ヘテロ細胞)において顕著な熱誘発性カルシウム放出が確認されました。一方、ホモ細胞への熱刺激時には、「熱誘発性カルシウム放出」によるCa2+の放出よりも、筋小胞体にCa2+を取り込むポンプの役割を果たす筋小胞体Ca²⁺-ATPaseによるCa2+取り込み促進の効果の方が大きいことが観察されました。これは、ホモ細胞では細胞内のCa2+濃度が高い反面、筋小胞体内のCa2+が著しく枯渇しているためであると考えられます。
・熱産生計測
最後に、細胞内のCa2+の上昇が実際に温度上昇を引き起こすか否かを明らかにするために、鈴木団講師らが新規に開発していた蛍光温度計「ERthermAC」[※6]とCa2+に対する蛍光指示薬[※7]をMHモデルマウスのヘテロ細胞に適用し、イソフルラン麻酔投与時、細胞内温度と細胞内Ca2+濃度の変化を単一細胞において同時に測定しました。そして、イソフルラン麻酔投与時に、細胞内温度と細胞内Ca2+濃度がいずれも上昇することを確認しました(図3)。すなわち、イソフルラン麻酔で引き起こされる悪性高熱症を、単一細胞レベルで再現することに成功しました。
研究の意義
本研究の結果は、悪性高熱症の分子レベルでのメカニズム解明に重要な知見を与えるとともに、予防戦略や画期的な創薬の開発を強力に促すものと期待されます。
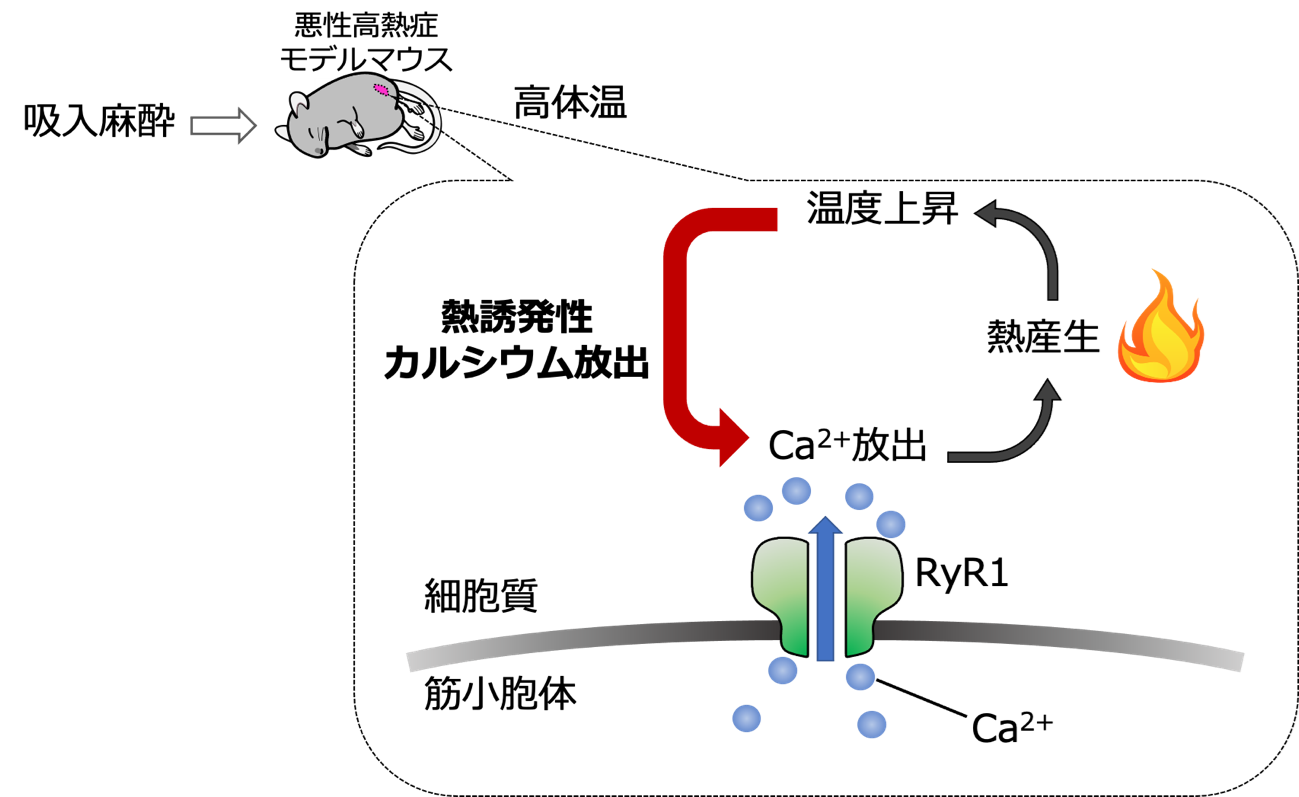
図1 熱誘発性カルシウム放出のメカニズム
骨格筋細胞に熱刺激が加わることで、骨格筋細胞内のカルシウムイオン(Ca2+)の貯蔵庫である筋小胞体から、1型リアノジン受容体(RyR1)を介して細胞内へCa2+が放出されます。Ca2+は骨格筋の熱産生を促進し、体温上昇を引き起こすことが知られていました。また我々は先行研究で、温度の上昇が熱刺激となり、Ca2+のさらなる放出が促されることを発見し、この現象を「熱誘発性カルシウム放出」と名付けました(赤色の矢印)。

図2 野生型とホモ接合体のサルコメア長の比較
悪性高熱症モデルマウス(ホモ接合体)の骨格筋細胞を電子顕微鏡で観察しました。ホモ接合体では野生型と比べてサルコメアの長さが短くなっていることを確認しました。黄色い矢印はサルコメアを示します。
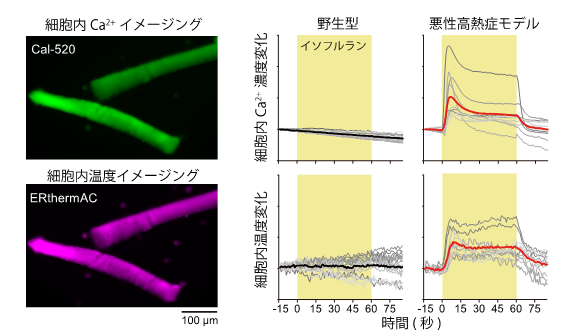
図3 イソフルラン投与後の悪性高熱症モデルマウスと野生型の比較
RyR1に変異のある悪性高熱症モデルマウスと野生型マウスより調製した骨格筋細胞にイソフルラン麻酔を投与しました。野生型マウスの骨格筋細胞ではイソフルラン麻酔によって細胞内温度、細胞内Ca2+濃度に変化は見られませんでした。悪性高熱症モデルマウスの骨格筋細胞では、イソフルラン麻酔によって細胞内温度と細胞内Ca2+濃度がほぼ同時に上昇しました。
*細胞ひとつひとつの変化を灰色の細い線、野生型マウスの変化の平均を黒色の太い線、悪性高熱症モデルマウスの変化の平均を赤色の太い線で示しました。薄い黄土色で示した時間(0~60秒)においてイソフルラン麻酔を投与しました。
用語説明
※1 悪性高熱症
吸入麻酔や筋弛緩薬の投与を受けた後に体温の上昇、筋肉の硬直などの症状が見られる病気です。適切な処置がなされない場合、死に至ることもあります。
※2 ホモ接合体、ヘテロ接合体
遺伝子は1個体当たり、父親由来と母親由来の2コピー存在します。ヘテロ接合体の場合には、正常遺伝子を1コピーと変異遺伝子を1コピー、ホモ接合体の場合には、変異した遺伝子を2コピー有します。
※3 骨格筋型リアノジン受容体(RyR1)
骨格筋の筋小胞体というCa2+を貯蔵している場所にあるCa2+チャネルです。細胞への刺激に反応して筋小胞体からCa2+を放出します。
※4 イソフルラン
全身麻酔の手術の際に使われる吸入麻酔薬です。悪性高熱症や呼吸抑制、アナフィラキシーなどの副反応を引き起こすことがあります。
※5 サルコメア
筋肉における筋収縮の機能上での最小単位の構造です。
※6 ERthermAC
細胞内の温度変化を蛍光シグナルの変化として観測することのできる新しい蛍光温度計です。温度が上昇すると蛍光強度が低下します。
※7 Ca2+蛍光色素
細胞内のCa2+を蛍光シグナルとして観測することのできる蛍光色素です。細胞内のCa2+が高くなると蛍光強度が上昇します。
引用文献
- (1) Yamazawa, T., T. Kobayashi, N. Kurebayashi, M. Konishi, S. Noguchi, T. Inoue, Y.U. Inoue, I. Nishino, S. Mori, H. Iinuma, N. Manaka, H. Kagechika, A. Uryash, J. Adams, J.R. Lopez, X. Liu, C. Diggle, P.D. Allen, S. Kakizawa, K. Ikeda, B. Lin, Y. Ikemi, K. Nunomura, S. Nakagawa, T. Sakurai, and T. Murayama. 2021. A novel RyR1-selective inhibitor prevents and rescues sudden death in mouse models of malignant hyperthermia and heat stroke. Nat Commun. 12:4293.
- (2) Oyama, K., V. Zeeb, T. Yamazawa, N. Kurebayashi, F. Kobirumaki-Shimozawa, T. Murayama, H. Oyamada, S. Noguchi, T. Inoue, Y. U. Inoue, I. Nishino, Y. Harada, N. Fukuda, S. Ishiwata, and M. Suzuki. 2022. Heat-hypersensitive mutants of ryanodine receptor type 1 revealed by microscopic heating. Proc Natl Acad Sci U S A. 2022;119(32):e2201286119.
関連する過去のプレスリリース
- (1)2021年7月14日「悪性高熱症および重度熱中症に対する新規治療薬候補を創出~ より安全な悪性高熱症治療へ向けて ~」http://www.jikei.ac.jp/news/press_release_20210714.html
- (2)2022年8月8日「熱中症の発症予測・メカニズム解明にも寄与 タンパク質の過敏な熱応答で体温上昇が止まらない!―悪性高熱症の熱産生暴走メカニズム―」http://www.jikei.ac.jp/news/press_release_20220808.html
http://www.protein.osaka-u.ac.jp/achievements/20221007/
論文情報
タイトル:Mice with R2509C-RYR1 mutation exhibit dysfunctional Ca2+ dynamics in primary skeletal myocytes
著者:Yoshitaka Tsuboi1*, Kotaro Oyama2*, Fuyu Kobirumaki-Shimozawa3, Takashi Murayama4, Nagomi Kurebayashi4, Toshiaki Tachibana1, Yoshinobu Manome1, Emi Kikuchi1, Satoru Noguchi5, Takayoshi Inoue5, Yukiko U. Inoue5, Ichizo Nishino5, Shuichi Mori6, Ryosuke Ishida6, Hiroyuki Kagechika6, Madoka Suzuki7#, Norio Fukuda3#, Toshiko Yamazawa1# (*co-first authors; #co-corresponding authors)
DOI番号:https://doi.org/10.1085/jgp.202213136
- J.Gen. Physiol. 2022 Vol. 154 No. 11 e202213136
著者(日本語表記):坪井義高1*、大山廣太郎2*、小比類巻生3、村山尚4、呉林なごみ4、立花利公1、馬目佳信1、菊地恵美1、野口悟5、井上高良5、井上由紀子5、西野一三5、森修一6、石田良典6、影近弘之6、鈴木団7#、福田紀男3#、山澤德志子1# (*共同第一著者; #共同責任著者)
著者所属
- 東京慈恵会医科大学 総合医科学センター 基盤研究施設
- 国立研究開発法人量子科学技術研究開発機構
- 東京慈恵会医科大学 細胞生理学講座
- 順天堂大学 細胞・分子薬理学講座
- 国立精神・神経医療センター 神経研究所
- 東京医科歯科大学 生体材料工学研究所
- 大阪大学 蛋白質研究所
研究支援
本研究はJSPS科研費(19K07306, 20H04511, 21K09755, 22H05055, 22H05053, 22H05054, 21K06789, 20H03421, 21K19929, 19H03404, 22H02805, 19K07105, 19H03198, 22H03198)をはじめとした多くの支援を受け多施設との共同研究により実施されました。本研究にご協力いただいたすべての皆様に深謝いたします。
【蛋白質研究所】研究者紹介:鈴木 団 講師(常勤)

―本研究成果の苦労された点は?―
悪性高熱症という病気について、モデルマウスの細胞を用いた研究を行いました。研究に必要な細胞を準備するにあたり、当初に想定していた方法では上手く準備ができず、最初のハードルとなり一番苦労をしました。成長過程のうち、今回の解析に適切な段階を見いだしてからは、上手く進みました。
―ひと言コメントをお願いいたします―
私が担当した実験の見どころは、悪性高熱症を細胞1個のレベルで再現することに挑戦し、そして世界で初めて成功した点です。
私はこれまで、熱刺激に対する細胞の応答を測る技術、そして一つ一つの細胞で温度変化を測る技術の開発を進めてきました。今回の共同研究では、重篤な疾患である悪性高熱症の原因となる蛋白質の性質を調べるために、これら二つの技術が組み合わされて使われたことを、とても嬉しく思っています。






