ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- 慢性疾患・脳疾患治療の可能性を開く人工成長因子
プレスリリース
2022.11.08
慢性疾患・脳疾患治療の可能性を開く人工成長因子
金沢大学がん進展制御研究所/ナノ生命科学研究所の酒井克也准教授、松本邦夫教授、大阪大学蛋白質研究所の高木淳一教授、東京大学大学院理学系研究科の菅裕明教授らの共同研究グループは、環状ペプチドとタンパク質工学の融合技術によって、 有効血中濃度が数週間保たれる人工成長因子や、 末梢から投与しても脳内に到達する人工成長因子の創成に成功しました。
インスリンなどの細胞成長因子は微量でも優れた生理活性を発揮するタンパク質で医薬品として利用されていますが、一般に血中半減期が短く、脳内の神経に到達できないため、慢性疾患や中枢神経疾患の治療に利用することは困難でした。本研究グループは、細胞成長因子受容体に結合する環状ペプチドの活性配列を、血中に長期に維持される抗体Fc分子内や、脳内移行性をもつ抗体分子内に内挿することによって、有効濃度が長期に維持される人工成長因子や脳内移行性を持つ人工成長因子を開発しました。
この方法によって、細胞成長因子の優れた生理活性が肝硬変などの慢性疾患やパーキンソン病などの中枢神経疾患の治療に活用されることが期待されます。
本研究成果は、2022年11月7日午後4時(英国時間)に英国科学誌『Nature Biomedical Engineering』のオンライン版に掲載されました。
1.研究の背景
細胞成長因子の性質はアミノ酸配列に規定されます。本研究グループは本来のアミノ酸配列とは無関係な人工成長因子を開発することによって、血中半減期が短い、脳内に到達できないといった成長因子の欠点を克服する分子の創成を目指しました。その結果、これまでに、RaPID(Random non-standard Peptides Integrated Discovery)法(※1)で得られる医薬標的タンパク質に結合する環状ペプチドの活性配列を、投げ縄(Lasso)状にタンパク質の表面のループ構造の中に埋め込むことで、環状ペプチドの機能と足場タンパク質の機能を併せ持つ分子を創成することに成功していました(図1)。
2.研究成果の概要
細胞成長因子は細胞膜を貫通する受容体同士をドッキングし、これによって受容体は活性化します(図2)。本研究グループは、受容体に結合する環状ペプチドを抗体分子のFc部分に2つ提示することで、2つの受容体を人為的にドッキングできると予想しました(図2右)。そこで、環状ペプチドのライブラリからRaPID法を用いて取得したMet受容体結合環状ペプチド(aMD4)を抗体Fcの8箇所のループ構造に内挿し、適切な位置に提示することで受容体の活性化が可能であることを示しました(図3a,b)。さらに,高速原子間力顕微鏡(高速AFM)を用いて受容体のドッキングした動態を観察することに成功しました(図3c)。作成したFc(aMD4)B3は、Met受容体を活性化する本来の成長因子である肝細胞成長因子(HGF)(※2)と同等の生物活性を持つことが、培養肝細胞や肝細胞ヒト化マウスで確認されました。また、血中レベルが長期に維持される抗体Fcの特性は損なわれることなく、Fc(aMD4)B3をマウスに投与すると2週間にわたり血中有効濃度が保たれました(図4a)。さらに、既存技術である脳内移行性を持つ抗トランスフェリン受容体抗体にaMD4を内挿することによって、この人工成長因子を脳内に届けられることを示しました(図4b)。
3.今後の展開
Met受容体の活性化は肝臓の再生や神経細胞の保護に働くことから、創成した人工成長因子は肝炎や肝硬変などの慢性疾患や、脳梗塞やパーキンソン病などの中枢神経疾患の治療に活用されることが期待されます。さらに、今回の研究手法がMet受容体以外のさまざまな成長因子受容体に展開されることによって、これまで治療が困難であった慢性疾患や中枢神経疾患に対する新たな治療法が開発されることが期待されます。
本研究は、文部科学省世界トップレベル研究拠点プログラム(WPI)、国立研究開発法人日本医療研究開発機構(AMED)肝炎等克服実用化研究事業(肝炎等克服緊急対策研究事業)「環状ペプチドファルマコフォア内挿型の組換えアゴニストによる肝機能・線維化改善に基づく汎用的肝炎治療の開発」(研究代表者 酒井克也,JP21fk0210087)、創薬等ライフサイエンス研究支援基盤事業「Structure-based protein designを駆使した抗体代替物の創成と高難度組換え蛋白質生産の支援」(研究代表者 高木淳一、JP19am0101075)「特殊ペプチド探索技術が加速する生命科学と創薬の支援」(研究代表者 菅裕明,JP19am0101090)、独立行政法人日本学術振興会科学研究費助成事業の支援を受けて実施されました。 
【図1】ラッソ・グラフト法
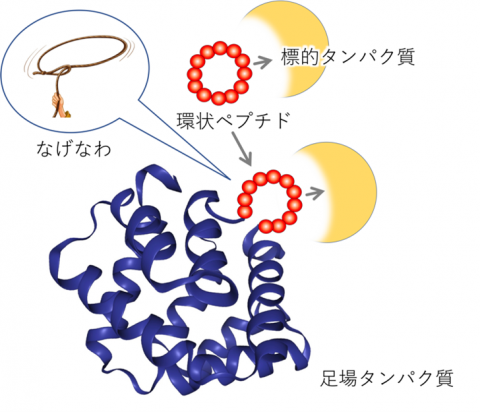
医薬標的タンパク質に結合する環状ペプチドの活性配列を、投げ縄(Lasso)状にタンパク質の表面のループ構造の中に埋め込むことで、環状ペプチドの機能と足場タンパク質の機能を併せ持つ分子を創成する。
【図2】成長因子受容体の活性化
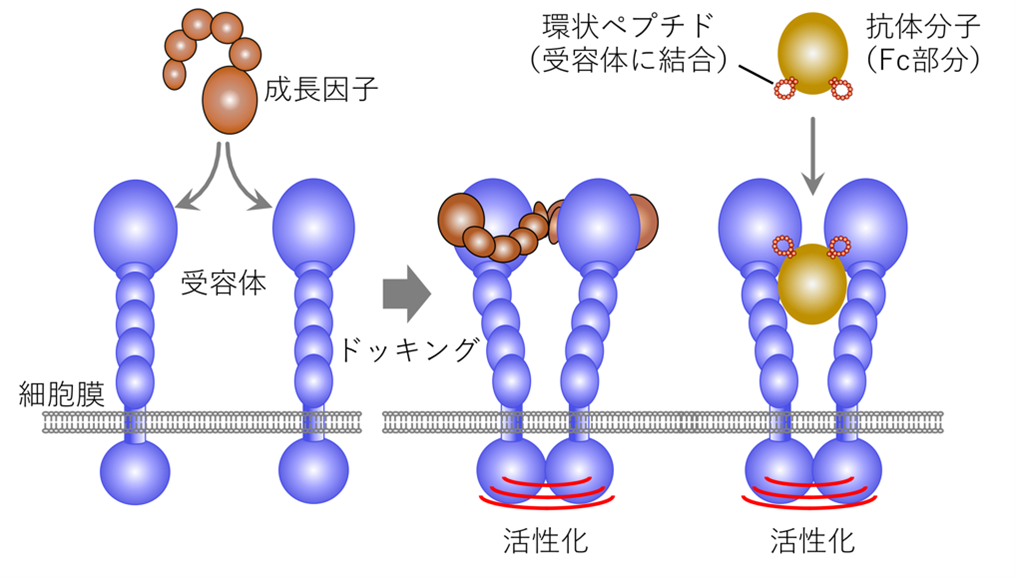
2つの受容体がドッキングすることでお互いを活性化する。受容体に結合する環状ペプチドを2つ提示した抗体Fc分子は、受容体のドッキングを促し活性化すると予想された。
【図3】 Met受容体を活性化する人工成長因子の創成
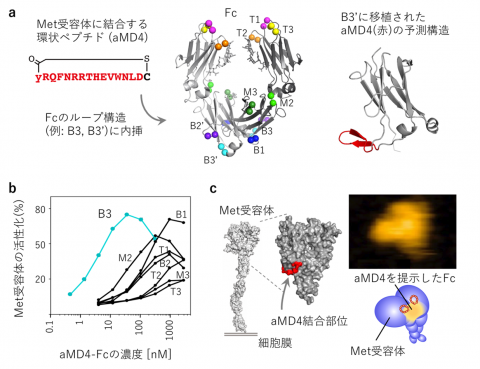
(a) Fcのループ構造(T1〜B3)の1組ずつにMet受容体結合環状ペプチドaMD4を内挿した。(b) 人工成長因子Fc(aMD4)B3は細胞上のMet受容体を活性化する。aMD4についてはB3ループへの内挿が最も活性が高い。(c) 人工成長因子Fc(aMD4)B3は2分子のMet受容体をドッキングする。右写真は高速原子間力顕微鏡(高速AFM)による観察。
【図4】長期血中動態と脳内移行性を持つ人工成長因子
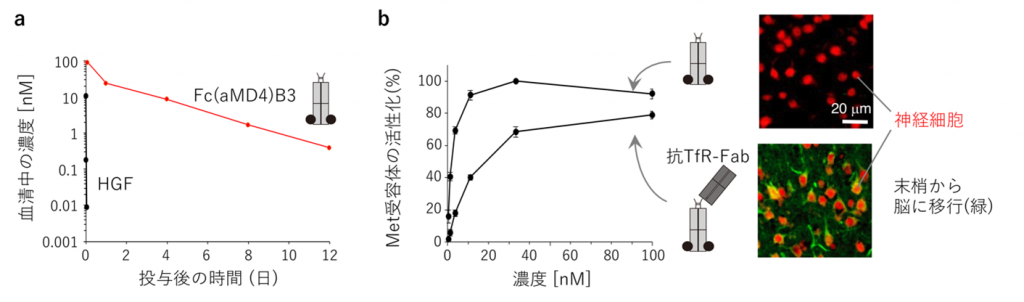
(a) Met本来のリガンドHGFは血中半減期が非常に短いが、Fcに基づく人工成長因子Fc(aMD4)B3は血中半減期が長い。(b) 抗トランスフェリン受容体(TfR)抗体に基づく人工成長因子は、末梢に投与した1日後に脳内の神経細胞(赤)に届いている(緑)。
用語解説
※1 RaPID(Random non-standard Peptides Integrated Discovery)法
東京大学の菅裕明教授が開発した方法で、遺伝子コードの再プログラミングとmRNAディスプレイを組み合わせて、1012以上からなるランダム配列から、標的に対して高い親和性と結合特異性を示す大環状ペプチドを取得する技術。
※2 Met受容体と肝細胞成長因子(HGF)
Met受容体は受容体型チロシンキナーゼであり、HGFによってドッキング (二量体化)することによってお互いの細胞内チロシン残基をリン酸化し活性化する。Met受容体の活性化は上皮細胞や神経細胞の増殖、生存、遊走などさまざまな細胞応答を誘導し、肝臓や腎臓の再生や神経の保護に働く。
論文情報
雑誌名:Nature Biomedical Engineering
論文名:Designing receptor agonists with enhanced pharmacokinetics by grafting macrocyclic peptides into fragment crystallizable regions
(環状ペプチドを用いた投げ縄グラフトFcによるデザイナー受容体アゴニストの創成)
著者名:Katsuya Sakai*, Nozomi Sugano-Nakamura, Emiko Mihara, Rojas-Chaverra NM, Sayako Watanabe, Hiroki Sato, Ryu Imamura, Dominic Chih-Cheng Voon, Itsuki Sakai, Chihiro Yamasaki, Chise Tateno, Mikihiro Shibata, Hiroaki Suga, Junichi Takagi*, and Kunio Matsumoto*
(酒井克也1,2*,中村希3,三原恵美子3,ロハス チャベラ ニコル マルセラ1,渡邊咲耶子3,佐藤拓輝1,4,今村龍1,2,ドミニク チン チェン ブーン1,4,
酒井伍希1,山崎ちひろ5,立野知世5,柴田幹大2,4,菅裕明6,高木淳一3*,松本邦夫1,2,4*)(*責任著者)
- 金沢大学がん進展制御研究所
- 金沢大学ナノ生命科学研究所
- 大阪大学蛋白質研究所
- 金沢大学新学術創成研究機構
- 株式会社フェニックスバイオ
- 東京大学大学院理学系研究科
掲載日時:2022年11月7日午後4時(英国時間)にオンライン版に掲載
DOI: 10.1038/s41551-022-00955-6
https://www.nature.com/articles/s41551-022-00955-6
【蛋白質研究所】研究者紹介:高木 淳一教授(分子創製学研究室)

高木 淳一教授
―ひと言コメントをお願いいたします―
当研究室の技術で開発した、抗体のFc領域をベースにした人工タンパク質を「Mirabody(MiraはMiracleと未来をかけている)」と呼んでいます。本論文ではMETという受容体を活性化するMirabodyをつくり、最近発表した別の論文(Sugano-Nakamura et al. Structure, 2022)ではPlexinB1という受容体を活性化もしくは不活性化するMirabodyを作りました。様々な疾患を標的とした新しいバイオ医薬を、蛋白質科学の力で創り出したいと思っています。






