ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- 複雑な形状を持つタンパク質をゼロから人工設計することに成功
プレスリリース
2024.01.05
複雑な形状を持つタンパク質をゼロから人工設計することに成功
発表のポイント
・これまで設計が困難であったαヘリックスが不規則に並ぶ複雑な形状のall α型タンパク質の人工設計に世界で初めて成功した。
・タンパク質の2次構造(#1)がαヘリックスのみから構成されるall α型タンパク質について、自然界に典型的に見られる18個のヘリックス-ループ-ヘリックス(HLH)モチーフと、ヘリックスの長さを組み合わせることで、αヘリックスが平行に並ぶシンプルな形状から、不規則に並ぶ複雑な形状まで多様な立体構造を生成できることを計算機シミュレーションで示した。そして、生成した構造の中から5つの異なる構造を選び、これらに折り畳むアミノ酸配列を計算機で人工設計し、生化学実験でそれらの折りたたみ能を実証した。これにより、計算機で生成した多様な立体構造が実際に設計可能であることを示した。
・タンパク質の機能は、タンパク質が形成する立体構造に基づいて発現される。今回の研究で、多様で複雑な形状のタンパク質を設計することが可能になるため、機能性タンパク質の創出につながることが期待される。
概要
自然科学研究機構 分子科学研究所 協奏分子システム研究センター/生命創成探究センター 生命分子創成研究グループの佐久間航也総合研究大学院大学大学院生(当時)小林直也特任研究員(現:奈良先端科学技術大学院大学助教)小杉貴洋助教、古賀(巽)理恵特任研究員(現:大阪大学蛋白質研究所助教)、古賀信康教授(現:大阪大学蛋白質研究所教授)は、理化学研究所生命機能科学研究センターの小林直宏上級研究員、長島敏雄上級テクニカルスタッフ、大阪大学蛋白質研究所の杉木俊彦特任助教(現:北里大学薬学部准教授)、藤原敏道教授(現:大阪大学名誉教授)、千葉大学の鈴木花野特任研究員、村田武士教授と共同で、αヘリックスが不規則に並ぶ複雑な形状のall α型タンパク質の立体構造を人工設計する技術を開発し、これを用いることで、5または6本のαヘリックスからなる5つの異なる複雑な形状のall α型タンパク質の人工設計に世界で初めて成功しました。本研究成果は、学術誌「Nature Structural and Molecular Biology」に2024年1月4日付でオンライン掲載されました。
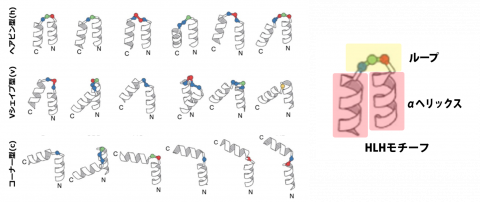
18個の典型的なHLHモチーフ
自然界で典型的に観測されるHLHモチーフ18個それぞれが、リボンで表されたαヘリックスと、それらを連結するループで表されている。球はターンを構成する、ひとつずつのアミノ酸残基を表現し、球の色はそれらアミノ酸残基のおおよその局所的な形状を表す。折れ曲がり角度の程度によって、ヘアピン型(h)、Vシェイプ型(v)、コーナー型(c)の3つに分類されている。
用語解説
(#1) タンパク質の階層構造:1次, 2次, 3次構造
タンパク質は1次から4次の階層構造を持つ。1次構造はアミノ酸の配列、2次構造はαヘリックスとβシートと呼ばれる規則的な水素結合で形成される局所的な構造、3次構造は3次元的に配置された2次構造がループで連結されたもの。
論文情報
掲載誌:Nature Structural and Molecular Biology
論文タイトル:“Design of complicated all-α protein structures”
(「複雑なall-αタンパク質構造の人工設計」)
著者:Koya Sakuma†, Naohiro Kobayashi†, Toshihiko Sugiki, Toshio Nagashima, Toshimichi Fujiwara, Kano Suzuki, Naoya Kobayashi, Takeshi Murata, Takahiro Kosugi, Rie Tatsumi-Koga, and Nobuyasu Koga*(†共同筆頭著者、*責任著者)
掲載日:2024年1月4日(オンライン公開)
URL: https://www.nature.com/articles/s41594-023-01147-9
DOI: 10.1038/s41594-023-01147-9
プレスリリース資料はこちらをご覧ください。
研究者からひと言

左から、古賀信康 教授・巽理恵 助教
対称的で規則正しい二重螺旋構造をもつDNAと比べて、多くの自然界のタンパク質は、対称性や規則性のない複雑な分子構造をしています。本研究では、どのようにすれば、このような複雑な形状を持つタンパク質を創り出すことができるのか、その設計原理の一端を解明することができました。この研究は多くの方々の協力のもと実施することができました。ありがとうございました。

藤原敏道 名誉教授
蛋白研では、共同利用・共同研究拠点として大型機器を用いてタンパク質の立体構造を調べる最先端の方法を整備して、全国の研究者に提供しています。古賀信康教授らとの今回の共同研究では、私たちが開発してきた溶液状態のタンパク質を対象にする核磁気共鳴法を用いることで、初めて多数の立体構造を迅速に決めることができました。これによって、医療や産業にも利用できるタンパク質構造デザインの可能性を示せたと考えます。今後もこのように異なる分野の研究者と協力することで、タンパク質科学やその応用に貢献できればと思います。






